Золото – елемент, метал, мінерал
Опубликовано 21. Бер, 2011 в Золото
 У Періодичній системі елементів золото займає 79-у позицію (порядковий номер), його відносна атомна маса 197,2 (за різними даними, 197,9 або 196,9). Вже відомо 14 його ізотопів з масовими числами від 192 до 206, із них стабільним є лише один — 197Аu, всі інші радіоактивні з періодами напіврозпаду від перших секунд до кількох діб (років?) і в природі, мабуть, не існують.
У Періодичній системі елементів золото займає 79-у позицію (порядковий номер), його відносна атомна маса 197,2 (за різними даними, 197,9 або 196,9). Вже відомо 14 його ізотопів з масовими числами від 192 до 206, із них стабільним є лише один — 197Аu, всі інші радіоактивні з періодами напіврозпаду від перших секунд до кількох діб (років?) і в природі, мабуть, не існують.
Хімічно чисте золото — важкий, блискучий, яскраво-жовтий метал. Якщо ж воно перебуває у тонкодисперсному стані, то змінює свій колір від пурпурового до синьо-сірого й навіть чорного. Введені в золото різні домішки надають йому розмаїтості забарвлення: мідь — жовтогаряче-червоного, срібло — блідо-жовто-зеленого, кадмій — зеленуватого, кобальт — блакитного, алюміній — бузкового, залізо – сірого, нікель і паладій — білого. Поєднуючи з золотом найбільш близькі елементи (мідь і срібло) у різному співвідношенні, можна отримати різні кольори: жовтий, білий і червоний з блідими зеленуватими відтінками. Хімічно чисте золото — м’який, ковкий, тягучий метал з високою густиною (19,3 г/см3). Температура плавлення 1064,4°С, температура кипіння 2947°С. Самородне золото має дещо нижчу густину – від 18 до 18,5 г/см3.
Взагалі золото вважають рідкісним елементом. Але на Землі є елементи (метали) ще більш рідкісні — реній, радій. Золото належить до так званих благородних металів, тобто має особливі хімічні властивості. Коротко розглянемо їх.
Золото — елемент першої групи Періодичної системи елементів, її побічної підгрупи, до якої, крім нього, належать мідь і срібло. Це підгрупа малоактивних металів, які мають багато спільних ознак і помітно відрізняються від своїх сусідів по групі — лужних металів. Як відомо, метали активно вступають у хімічні реакції з галогенами, сіркою, киснем та іншими елементами, віддаючи їм свої електрони (окислення). На зовнішньому електронному рівні атомів як лужних металів (Li, Na, K, Rb, Cs, Fr), так і міді, срібла та золота міститься по одному електрону, отже всі вони мали бути одновалентними. Але на відміну від лужних металів, в яких єдиний електрон зовнішньої орбіти легко відривається від атома, у міді, срібла та золота він відривається важко, як правило, разом ще з одним чи двома електронами передостанньої орбіти, утворюючи сполуки з валентністю елемента 1 і 3. Експериментально отримано сполуки з валентністю золота 5 і 7. Чому так неохоче його атом віддає свій зовнішній електрон? Це зумовлене дуже низьким ефектом екранізації ядра атома золота його проміжними електронами й звідси — високою енергією іонізації, тобто енергією, яка потрібна для відриву електрона від атома. Саме завдяки високій енергії зв’язку зовнішнього електрона золота з ядром атома, воно виявляє значно меншу хімічну активність, ніж лужні метали й навіть срібло чи мідь. У цьому й полягає благородність золота, тобто його хімічна інертність і прагнення до самородного стану. Серед елементів, що утворюють природні виділення у самородному стані, золото займає чільне місце.
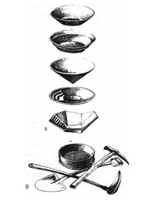
Знаряддя праці золотошукача: а) лотки: фінський, канадський, китайський, американський, російський; б) сито, лопата, мотика, молоток
Чи справді цей метал настільки хімічно стійкий? На перший погляд здається, що на повітрі, у кисні та воді він майже не змінюється. Вважають, що золото не реагує з азотом, воднем, киснем і вуглецем, навіть за високих температур. Але більш детальні дослідження показують, що на поверхні золота утворюється дуже тоненька окисна плівка.
Крім того, золото не зовсім «байдуже» до таких окислювачів, як галогени (хлор, бром), кислоти (суміш азотної та соляної кислот – царська горілка, суміш сірчаної й марганцевої кислот, селенова кислота), ціанисті солі, полісульфати лужних елементів та інші активні речовини. Коли золото сполучається з хлором у присутності води, утворюється хлорне золото (AuCl3), яке на світлі поступово розкладається. В царській горілці золото добре розчиняється, утворюючи сполуку Н (AuCl4). Розчиняють золото також деякі органічні речовини, наприклад, гумусові кислоти. Найбільш стійкі й характерні ті сполуки, в яких золото тривалентне. Таке золото має властивість утворювати комплексні аніони. Отже, цей елемент не такий вже й невразливий. В природній воді він утворює складні комплекси (хлоридні, гідро-сульфідні та ін.) із ступенем окислення 1 та 3 і переноситься водним середовищем, за певних умов може випадати й нагромаджуватися в окремих ділянках земної кори. Вважається за можливе перенесення золота сухими газоконденсатними потоками воднево-вуглеводневого складу.
Найбільш тісні асоціації в природі золото утворює із своїми найближчими сусідами по Періодичній системі елементів, які майже всюди його супроводжують. Це срібло та мідь, вони разом із золотом утворюють так звану мідно-срібно-золоту вісь. Ліворуч цієї осі маємо елементи, концентрації яких (особливо Ni, Pd, Pt) зв’язані з магмами основного складу, головним чином мантійного походження. Праворуч осі розмістилися елементи, асоціації яких характерні, як вважає чимало з дослідників, для кислих чи змішаних магм або взагалі для корових порід та руд. Стабільною є асоціація Au – Ag – Cu (названа Н. В. Петровською (1973) геохімічною тріадою елементів), що бере участь у всіх циклах ендогенної міграції золота. Але, як зазначалось, мідь і срібло не зовсім подібні до золота за рядом властивостей, в тому числі й за потенціалом іонізації (значно меншим, ніж у золота). Цим зумовлена самостійність їх поведінки в деяких природних процесах, особливо в зоні гіпергенезу, де їх шляхи часто розходяться. Інші супутні золоту елементи утворюють у ньому домішки, склад і концентрація яких менш постійні. Великий знавець золота Н. В. Петровська (1993) наводить ряд елементів-супутників золота, ступінь постійності яких зменшується в напрямку: Ag – Cu – Fe – Te(Se) – Hg – Sb – Bi – Pb – Zn – Pt – Mn. Звичайно, такий ряд дещо ідеалізований, бо в кожному золотоносному регіоні своя специфіка процесів міграції й випадання золота. І, безумовно, в тій чи іншій кількості срібло майже завжди супроводжує золото незалежно від зернин — від мікрочастинок до великих самородків.
Хімічні властивості золота зумовлюють особливості його мінералогії. Схильність цього елемента до «самостійності» визначає те, що серед його мінеральних форм панує самородне золото. Інші мінерали зустрічаються рідко й у малій кількості. На сьогодні їх встановлено близько чотирьох десятків {табл. 1), ще з десяток сполук цього елемента не мають назви (наприклад, сульфід золота й вісмута – AuBi5S4 чи арсенотелурид золота – Au3(Ag, Pb) As2T3). З 1950 р. відкрито понад 20 його мінеральних видів. Не всі відомі мінерали золота досконально вивчені. Безумовно, перелік їх зростатиме, принаймні тому, що список штучних сполук золота надто великий, хоча природні аналоги багатьох з них навряд чи будуть стійкими. Найбільш поширені в природі телуриди золота (петцит, сильваніт, калаверит та ін.). Сполуки золота з телуром (так зване парадоксальне золото) відкрито наприкінці XVIII ст., що й похитнуло тоді віру в інертність золота. Відомі його селеніди (фішесерит та ін.) і сульфіди (петровськаїт, ітенбогардтит та ін.), золото-вісмутові (мальдоніт) та золото-сурм’яні (ауростибіт) мінерали, складні мінерали з входженням Те, Pb і Cu (білібінськіт, безсмертновіт) і навіть кислородні сполуки золота (ауроантимонат та ін.).
Таблиця 1. Найбільш відомі мінерали золота
| Мінерал | Формула | Сингонія |
| Золото самородне | Au (Ag, Cu) | Кубічна |
| Аурикуприд | CuAu 3 | Кубічна (?), ромбічна (?) |
| Тетрааурикуприд | CuAu | Тетрагональна |
| Богдановит | (Cu Fe) (Au, Te, Pb) 3 | Кубічна |
| Анюйіт | Au (Pb, Sb) 2 | Тетрагональна |
| Амальгама золота | (Au, Ag) Hg – Au2 Hg3 | Кубічна |
| Вейсганіт | (Au, Ag)3 Hg 2 | Гексагональна |
| Звягінцевіт | (Pd, Pt, Au) 3 (Pb, Sn) | Кубічна |
| Безсмертновіт | Au3 Cu (Te, Pb) | Ромбічна |
| Білібінськіт | Au3Cu2PbTe2 | Кубічна (?) |
| Мальдоніт | Au3Bi | Кубічна |
| Петровськаїт | AgAuS | Моноклінна |
| Ітенбогардтит | Ag3AuS2 | Тетрагональна |
| Крідлеіт | Ag2Au3TeSb10S10 | Моноклінна |
| Пенжиніт | (Ag, Cu)4Au (S, Se)4 | Гексагональна |
| Фішесерит | Ag3AuSe2 | Кубічна |
| Петцит | Ag3AuTe2 | -“- |
| Мутманіт | (Ag, Au)Te | Ромбічна (?) |
| Монтбрейїт | (Au, Sb) 2 (Te, Bi) 3 | Триклінна |
| Нагіагіт | AuPb5(TeSb) 4S5-8 | Тетрагональна (?) |
| Костовіт | CuAuTe4 | Моноклінна |
| Сильваніт | (Au, Ag)2 Te4 | -“- |
| Кренерит | (Au, Ag) Te2 | Ромбічна |
| Клаверит | AuTe2 | Моноклінна |
| Ауростибіт | AuSb2 | Кубічна |
| Ауроантимонат | AuSbO3 | (?) |
Чистого золота в природі не існує. Воно завжди містить ті чи інші домішки. Різними аналізами у самородному золоті встановлено домішки Ag, Cu, Fe, Pb, Sb, As, Hg, Mn, Zn, Bi, Te, Se, Sn, Ti, Cr, Pt, Ni, Co та ін. Вміст срібла в самородному золоті визначає його пробу й залежить насамперед від глибинності рудоутворення. У малоглибинному золоті він становить у середньому 30 – 40 %, у глибинному – в середньому 5 – 15 %. Кристалізація високосрібного золота в малоглибинних рудах зв’язана з підвищенням окисного режиму у верхніх частинах земної кори. Золото з вмістом 30 — 60 % Ag називають електрумом, із вмістом понад 60 % Ag — кюстелітом. Проба золота визначається відношенням концентрацій CAu/( CAu+CAg)*1000. Розрізняють досить низькопробне золото — проба менше 600, низькопробне — проба 600-699, відносно низькопробне – 700 – 799, помірно високопробне (середня проба) – 800 – 899, високопробне – 900 – 950, досить високопробне — понад 950. Хоча штучно можна отримати неперервний ряд золото-срібних твердих розчинів, у природі, як вважають дослідники, тільки на початку процесу рудоутворення можуть виникати гомогенні тверді розчини Au – Ag, які згодом, протягом геологічного часу, розпадаються з утворенням більш стійких фаз на зразок AuAg і AuAg3.

Алхімічні знаки золота та найдавніший рецепт його на виготовлення від 300 р. до н.е. Єгипет (за кн.: J.Klominsky, J.Pacovsky Historie psana zlatem).
Вагомий вміст інших домішок в самородному золоті дозволив виділити такі його різновиди, як мідисте золото (близько 5-20 % Сu), вісмутисте (близько 4 % Ві), ртутисте (близько 5 % Нg), а також аргентокупроаурит. Ряди твердих розчинів із золотом утворюють платина (платинисте золото) і платиноїди: родит — з родієм, порпецит — з паладієм, іраурид — з іридієм, ауросмирид — з осмієм.
Крім геохімічної специфіки регіонів, у породах яких міститься золоте зруденіння, на склад і концентрацію елементів-домішок у самородному золоті значно впливає глибинність рудоутворення Так, у глибинних родовищах золото високопробне й найбільш чисте, з невеликим вмістом Ті, Сr, V, інколи Ni, Сo. В золоті із середньоглибинних родовищ містяться домішки Pb, Cu, Sn, Bi, Hg, з малоглибинних – Fe, Se, Mn, Te, Sb, Hg. Наскрізні домішки в золоті — це Ag, Fe, Cu, Pb, Zn. Мідисте золото поширене в районах активної дії основних і ультраосновних магм.
Самородне золото — це типовий гідротермальний мінерал. Його мінералогія цілком залежить від мінерального складу золотоносних руд. У родовищах золота встановлено понад 200 мінеральних видів і різновидів. Причому, мінерали срібла становлять близько 18 % загальної кількості мінералів у золотих рудах, далі йдуть мінерали (в %): сурми – 16, телуру – 10, свинцю — 9, заліза й міді — по 7.


